理解数据完整性
发布时间:2018-02-01 浏览次数:318次
在保障电子记录有效性方面我们之前讨论了数据访问权限的问题,其通过身份认证和内容的限制性访问保证了数据不受未经授权的更改,但仅仅控制对电子记录系统的访问并不能解决当前实验室的真正问题—数据完整性。我们依旧以下面的图来开始话题。
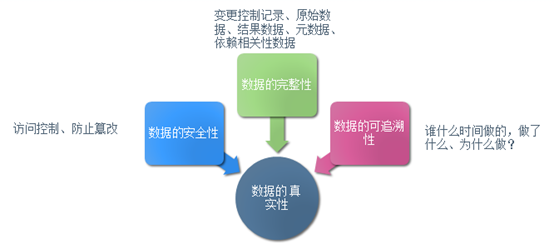
综合FDA以及欧盟药监机构对国内药厂检查情况来看,数据完整性缺失是出现频次相当高的问题,综合这些Warning letter 来看,原始数据缺失(故意删除,覆盖,丢失),分析结果无法重现,方法修改不能追溯,原始数据与样品无法关联等,出现这些问题的原因与检测实验室人员基本业务素质不高,粗心大意图一时方便,无相关数据管理知识和理念不无关系。
数据完整性的保证要基于两方面的知识,一个业务知识,另一方面是信息技术方面的知识。弥补了相关知识的不足,对照CFR Part11的相关条款,就能清楚地了解这些都是水到渠成,做到深入理解而不是机械照搬。
CFR Part11对电子记录的定义是指任何文本、图表、数据、声音、图示的或其他的以电子形式表现的信息的混合,它的建立、修改、维护、归档、检索或分发是由计算机系统来完成的。按照此定义,其清楚指明电子记录就是所有在计算机中创建和存储的数据。如果你打算在受法规监管的实验室中使用计算机设备,其产生并存储电子记录,就必须以电子格式保留,更明确地说,如果一条记录被认为是原始记录,就必须在可持续存储设备上维护和归档,例如常见的计算机硬盘。我们不能拿一份仪器工作站导出的纸质分析报告去做原始数据。
CFR Part11对数据完整性的说明一笔带过,十分简略,其在11.10b 作了如下阐述:”系统应能对所有要求的数据产生准确、完整的可读文档和电子文档,并且适合于FDA的检查、审核和复制。”相比而言,电子记录的审计跟踪和数据安全性,以及电子签名的说明是十分详尽的。在FDA和EDQM对国内药厂的检查过程中,数据完整性却又是常常出现问题的所在。
众多数据完整性问题发生的单位对数据完整性的理解比较片面导致问题出现不知道如何去正确地纠正以及预防。
电子化的数据分为四类,分别是:原始数据、元数据、结果数据、审计跟踪记录。
原始数据是大家最熟悉的,所谓原始数据就是最直接的,根源的数据。原始数据可以由以下方式产生(1)人工观察纸质记录,例如我们对实验现象观察后写在实验记录本上的描述性语言,或者是通过早期的打字机直接在纸张上将文字打印出来,该打印出来的纸张也是原始记录(2)仪器,简单设备通过各种复杂的,参数可高度配置化的计算机化系统产生的图谱,与人工记录类似的是仪器采集到数据后写入到存储介质上的信号而不是纸上。关于原始数据的认定,我们可以从仪器的复杂性去考察。
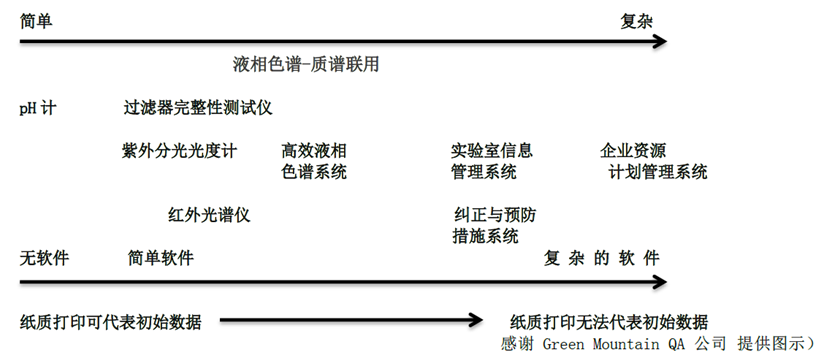
上图表示的是系统复杂性与可打印输出作为原始数据合理性的关系。对于一些简单系统(如pH计和天平)可能只要求进行校正,很多天平可以直接在打印纸上输出称量结果,早期的光谱仪的输出也是在计量纸上直接打印输出光谱图的,以上作为原始数据是十分合理的。由于计算机和仪器技术的飞速发展,现在的光谱仪往往配了计算机工作站,可调整的参数也更多。而复杂系统则需要对其既定用途进行验证和确认。验证与确认工作在图中从左到右随着系统复杂性增强而逐步增加,因为仪器可配置性越高,其数据就越容易伪造和篡改。往右到了色谱工作站,色谱数据系统(CDS)其可打印输出就完全丧失了作为原始数据的资格,即便打印出来并被分析员签字的报告也没有资格作为原始数据,这是因为被打印出来的电子记录通常是不完整和不准确的,缺乏一些重要的信息,如谱图处理过程参数和审计日志。在对复杂系统计算机验证的重视的同时也不能忽略了低复杂度系统。在这些系统中,用户可以捏造数据或重复测试以达到所想要的结果,而被发现的机会较低(例如,独立系统具有用户可设置参数的输出,例如,FT-IR,UV色谱仪)。
说到色谱图的过程处理参数,就要提到元数据。元数据就是关于数据的数据。举一个简单的元数据例子:对于一个Word文档来说,除了其包含的内容作为数据的主体,与之相关的还有文档位置、文档大小,文档作者以及创建日期等信息,这些信息就是这篇文档的元数据。具体到分析实验室的元数据,我们可以找出很多。针对一份样品的分析原始数据,与之对应的元数据包括分析人员、仪器运行过程控制参数、积分参数,响应因子、校正数据、创建日期、文件位置,以及其对该原始记录的变更信息。没有元数据就不可能重建用原始输入参数得到原始结果的过程,结果的可追溯性就会受到限制。有了以上的知识,我们就能明白打印出的报告并不会包含电子记录的所有数据,顶多只能作为临时的代表。总之,元数据是考察记录是否可信并符合FDA要求的关键。没有元数据相佐证的数据没有任何意义。
电子数据中的第三类结果数据或报告,可能在纸上,也可能保存在受控的电子文档管理系统中。所谓受控就是文档的提交,取出,编辑等对文档的变更操作系统均应有记录,并且具有版本管理的功能。结果和报告不是孤立存在的,还需要与其相关联的原始电子数据、数据发布或批准的电子签名,以及任何支撑结果报告的纸质记录建立有效链接,这涉及本文中的最后一个话题,后面再详细说明。
电子数据中的第三个内容是审计跟踪记录。全纸质记录年代,当我们进行记录的修订时就要求原来记录只能划底线标志要删除,然后在空白处写上变更内容,变更人、变更时间,这可以称得上是纸质版的变更记录。在各个研发机构中,纸质版的实验记录本一直就是其知识产权的主要载体,管理良好的规范化纸质记录能作为专利诉讼中的重要证明材料。也正是应为其敏感和重要,以及各国对电子化实验记录的认可方面的差异,这一领域的电子化过程步履艰难。采用电子记录,必然同样要求有电子化的变更记录,在21CFRPart11中对审计跟踪记录做了十分明确的要求:”使用安全的、计算机产生的、时间标记的审核跟踪以便独立地记录操作者登录和建立、修改、或删除电子记录的行为的日期和时间。记录的改变不能使先前的记录信息被覆盖。”电子化的审计跟踪记录可以不如纸版的那么清晰可见,但其要求一旦电子记录创建,系统必须跟踪所有修改(日期,时间,用户名,修改理由),审计跟踪功不能被用户关闭,改变或删除。电子记录的审计跟踪数据可以说是除安全性之后的首要考虑因素,其是电子记录可信的必要条件。但审计跟踪记录只是电子记录变更管理的一部分内容,从Part11的规定可看出其类似于操作日志,记录的是何人何时发生什么操作,为了实现完整的变更管理,还需要系统拥有版本修订控制功能,犹如Word中的修订功能一样,可以记录修订前后的值,组合起来就是何人何时将何对象从何值改为何值。
除了电子数据的四个主要内容的完整性外,我们还需要注意数据的参考完整性。数据参考的完整性即原始数据,元数据,结果报告之间的关系要完整并且正确。如果各个数据单元间的关系可以随意修改,那么这个数据网络就很难管理了。除了上面提到的结果报告与源数据关联的例子。在分析实验室我们还能举出一些更加实际的例子来。如果我们要对某个样品Y进行主要成分和杂质的定量分析,采用的方法A的第二个版本A2。在Y 的分析前,已经做好标准曲线,标准曲线涉及到标准品的制备和后续的数据拟合。当我们对样品Y进行第一针的分析时,由于色谱柱柱头漏液导致泵失压,放弃分析,此时系统产生对应样品Y的数据文件为Y-1,在修复系统后,重新对Y进样,此时应该产生数据文件Y-2,注意此处不应该将Y-1覆盖。分析完成后,按照标准曲线对主成分和杂质进行定量分析,生成结果Y2-A2-1(此处仅为代号)。至此,我们应该要求结果Y2-A2-1与原始数据Y2进行对应,原始数据Y2还应该与方法A的第二个版本A2对应,相关的标准曲线的样品原始数据和拟合结算结果也应与结果Y2-A2-1形成关联。更进一步,如果将来方法A发生了修改形成了新版本A3,当FDA来核查时,也能查看到当日产生结果的A3版方法的参数。推而广之,样品测试期间的仪器维护记录也应该能准确找出。
凡本网文章除非特殊注明,均属于点风信息科技有限公司原创作品,未经本网授权不得转载、摘编或利用其它方式进行商业化使用。已获本网授权的作品,应在授权范围内使用,并注明”来源:武汉点风信息科技有限公司”。违者本网将追究相关法律责任。

