GLP实验室计算机化系统变更风险管理指导
发布时间:2014-12-05 浏览次数:438次
GLP实验室计算机化系统变更风险管理指导
信息科技工作组(AGIT)
发布日期:2012年12月1日
版本1.0(翻译稿)
一、前言
本指南的目地是基于GLP合规性为计算机化系统验证的变更管理提供指导,该指南将帮助和促进设备测试使用一个共同标准,但并不具有法律约束力。
现行版的指南是由信息科技工作组发布(信息工作组,AGIT),该小组由代表瑞士工业和瑞士GLP监督机构的代表组成。该小组的目标是提出实用的、适用的、且符合监管要求的设备测试方法。以使在任何情况下,设备测试管理都可以选择符合GLP规范的不同方法。参见[1, 2, 3].
二、介绍
经过验证的计算机化系统的系统生命周期是从定义用户需求的文件时开始的。当发布新的计算机化系统后,需要一个变更管理程序来确保整个系统生命周期中验证状态的有效性。[3,变更控制]. 变更管理需要一个受控程序来监督,且通过文件记录新发布系统上的所有变更。在验证阶段,变更应该根据影响程度(风险评估)进行评估,并应采取适当措施以保持系统处于验证状态。
三、范围
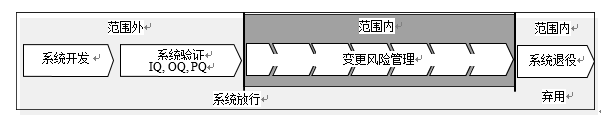
在GLP规范环境下的计算机化系统,在其使用之前必须经过验证,为确保验证状态的有效性,变更管理应该应用到系统退役,本指南描述了变更管理的流程和文件要求。
系统开发过程中的变更是本指南之外的范围。(见系统开发生命周期V模型[4])
系统验证过程和系统退役原则的内容请参见[4, 5],并不是该指南的一部分。
四、变更的类型
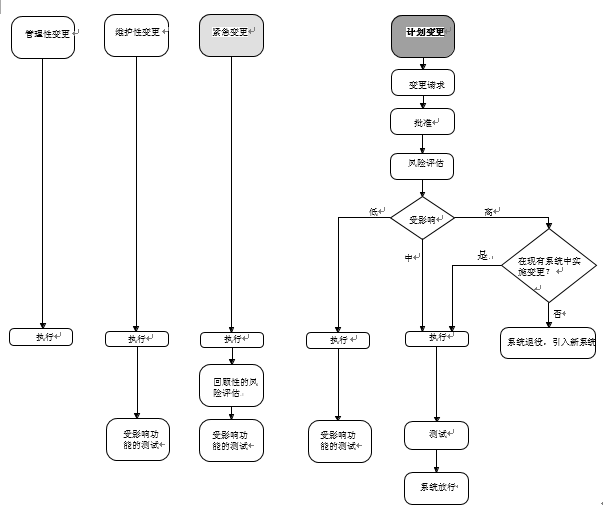
图2描述了不同类型的变更及其执行措施
图2:工作流程图
• 管理性变更
角色和职责的变更,如:系统负责人,注册用户,应在系统日志或系统日志文件中做相应地记录。若计算机化系统的功能不受影响,因此不需要采取进一步的措施。但是,应该考虑教育程度和培训,个人档案的更新也是必须的。
• 维护性变更
在定期维护计算机化系统时,可能需要对磨损的部件进行更换。但一般来说,这些变更不会影响系统的功能。这些变更的必须通过文件记录,可以通过几个选项来实现,如:维护报告、日志文件或日志文件中的详细文档。在某些情况下,应该执行功能控制测试,以确保系统功能的适用,应在SOP中定义哪些硬件组件属于”磨损部分”的范围。
在维护情况下的软件升级应该被认为是至关重要的,因为软件中所有变更的影响都应该被评估。因此,在这种情况下,在本指南建议遵循预期的变更流程。
• 紧急变更
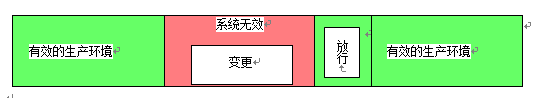
如果系统出现故障(例如:硬件损坏),则可能需要立即进行变更,以使系统重新投入使用。根据给定的事实,系统负责人和相关人员(例如:IT)应决定是否立即执行变更,以防止数据完整性的丢失。在这种情况下,应该对正式的变更控制程序(批准、文件起草、测试)进行回顾。根据回顾性风险评估的结果,或根据功能控制测试的负面结果,修复应遵循”计划性变更”的程序。在这种情况下,计算机化系统的状态应被认定为”未验证”。在执行紧急变更和放行期间,该系统不可被用于GLP研究。
• 计划变更
计划变更是系统的计划性升级或修改。详细的步骤如下所述。
五、计划变更的流程
• 变更请求
如果发生计划性变更,应向系统所有者提交一个书面请求。变更可以由不同方提出,例如用户、IT专家、QA、供应商、系统负责人、测试设备管理部门。
为了评估变更请求的重要性,变更请求应该清楚地描述变更,并包括变更的理由,例如:改进的功能、增加的功能、修复措施以及变更的紧迫性。此外,该描述应该包括系统的元素,被认为是有影响的元素(硬件、软件、接口、文件以及培训)。
为了支持请求的批准,对变更实施的总体工作量(测试和文档的工作量)的初步评估可能有助于在变更时做出业务决策。必须考虑到先前的经验和知识。整体的工作量可能很难预测,特别是具有中等或高影响的变更。
• 请求批准/拒绝
根据变更的理由和计划的内容,由设备测试管理部门或系统负责人代表设备测试的管理部门来批准或拒绝该请求,对于批准或拒绝,应该文件记录。另外一种选择是:在风险评估后再批准/拒绝请求。
• 风险评估
如果要使用新的或改进的功能,就需要相应地更新用户需求。
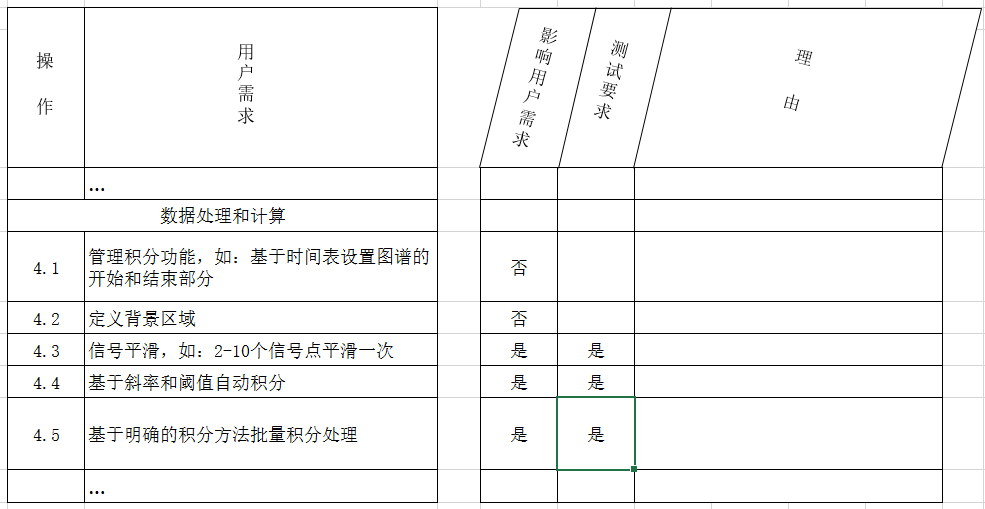
所有受影响的用户需求/功能规范都应该被确认。
对于每一个受影响的用户需求/功能规范,都应该进行测试。该决定应基于专业水平,可能对数据完整性、系统功能、实际应用程序和故障概率的影响。测试的范围应该在相应的测试计划/测试脚本中进行描述,如果对受影响的用户需求/功能规范不进行测试,应该给出一个合理的理由。
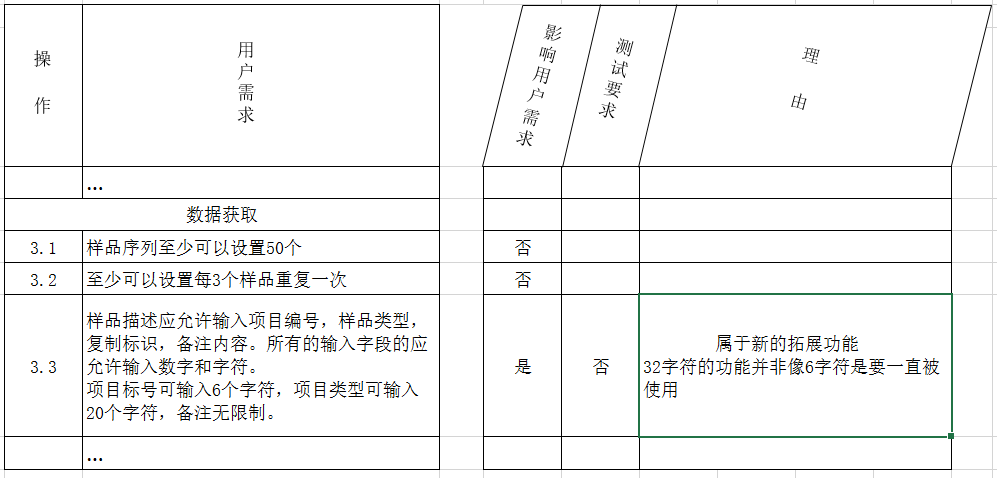
示例1:影响用户需求但不需进行测试
支持计划性变更的原因是:推荐升级软件版本。比如:旧版本与新版本的一个不同之处是:新版本允许在研究编号输入32个字符,而不是6个字符。用户所要求的可输入6个字符的需求不受影响,因此不需要测试。
示例2:影响用户需求且需要测试
新版本已优化了自动积分功能(新算法),有部分用户需求受到了影响,因此需要测试。
如果受影响的用户需求不需要进行测试,那么这种变更则被认为是低影响的变更。需要对一个或多个用户需求进行测试,则认定为是为一个中等或高影响的更改。中等影响、高影响的差异取决于测试的程度。
• 实施要求
如果计算机化系统中存在变更级别为低影响(的变更),则验证状态仍保持不变。但是变更和正常的计算机系统功能应该通过文件记录在系统文件和/或日志本中。如果有必要,应该执行功能控制测试以确保系统的正常功能。
如果计算机化系统中存在变更级别为中等/高影响(的变更),对于验证状态,变更执行时状态应改为”未验证”,且计算机化系统不可被用于GLP目的。在确认所有受影响的用户需求之后,应该建立一个测试计划(由系统负责人批准),以证明这些用户需求是经过测试的,且QA应该根据SOP来进行参与, 计划的测试应该执行并报告。或者,已经在SOP中定义了功能控制测试可以在适当的时候执行。如果有证据表明所有测试过的用户需求都满足要求,计算机化系统就适用它的预期用途,则计算机化系统可以由测试设备管理者/系统所有者放行,用于生产性的GLP研究使用。
在高影响的情况下,推荐正式退出当前系统、定义新系统,并启动新的验证程序,请参见[4]。
• 变更实施和验证状态
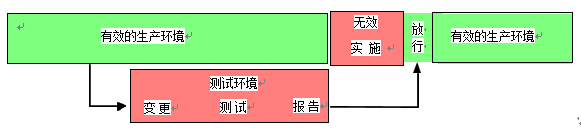
对于具有中/高影响的变更,在变更执行期间,应该认定计算机化系统将不能再有效地用于生产性的使用。强烈建议为变更执行建立一个扩展计划,可在计算机化系统的测试环境中执行计划性的测试,而未涉及变更的生产环境部分仍保持验证状态并可用于生产运行。在成功完成测试后,应在生产计算机化系统上实现变更,并且可能需要在生产环境中进行适当的测试以使系统优先放行。
如果测试环境不可用,则应该在生产系统上执行变更。在变更期间,计算机化系统不能用于GLP研究,直到系统由测试设备管理/系统负责人放行。
• 变更关闭
当系统文档更新时,低影响的变更会被关闭。在中/高影响的情况下,变更会随着系统的放行而关闭。变更的文件包括风险评估、测试计划、测试数据、测试报告、安装启用和系统版本,系统放行的文件是验证文件的补充。
六、故障处理
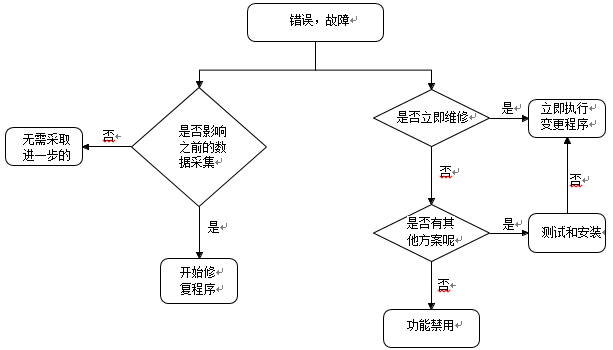
任何确认的错误或故障,在系统生命周期中应根据以下流程图方案记录和评估。所有的过程都应该并行执行,即评估对现有数据的影响和故障的修复。
任何可能对以前的数据采集或数据处理造成影响的都应该评估。如有影响,应首先对以前的数据进行更正,如,所有相关信息、最终报告修订、原始数据更正等。如果对数据没有影响,则不需要采取进一步的措施。这两种情况下,评估过程的结果都应记录在案。
为了进一步使用该系统,应由预期的变更过程启动立即变更程序。如果一个故障不能立即修复,则应该建立一个解决方案并测试,以避免正在进行的操作对数据完整性造成影响。可能的解决方案包括技术和/或操作性的措施,随后应将采取的措施传达给所有相关方,例如:用户、项目主任、QA。如果没有可行的相关措施,相应的功能应立即禁用或不再使用。
七、职责
本节描述变更管理程序的角色和职责。
设备测试管理部门对遵守GLP原则负有全面的责任。特别是,设备测试管理部门应该建立规程,以确保计算机化系统符合其预期目的,并且根据GLP的原则进行验证、操作和维护。对于计算机化系统的责任必须在政策和规程中进行定义和描述,此责任可委托给指定的系统所有者。
系统负责人负责确保特定的计算机系统按照GLP的原则进行操作和维护,并保持在已验证的状态。
参与测试的人员负责按照GLP原则和公认的技术标准进行实施。
质量保证(QA)应该在变更管理过程中协调各方。需要QA参与的职责部分应该在SOP中描述。QA应处理下列问题;
验证活动中的信息处理
文件审核(如:测试计划,测试报告)
实施检查
八、引用
[1]2005年5月18日《良好实验室规范条例》[RS 813.112.1]
[2]经济合作与发展组织关于良好实验室规范和合规监督,编号1: 经济合作与发展组织良好实验室实践原则(1997年修订)。环境理事会,经济合作与发展组织,巴黎,1998经济合作与发展组织关于良好的实验室规范和合规监测的原则,编号10:GLP共识文件。GLP原则在计算机化系统中的应用。环境专论116号文件;环境理事会,经济合作与发展组织,巴黎,1995年
[3]P.M. Esch, G. Donzé, B. Eschbach, S. Hassler, L. Hutter, H.P. Saxer, U. Timm, R. Zühlke, “Good Laboratory Practice
[4](GLP) – Guidelines for the Validation of Computerised Systems”, Qual. Assur. J. 2007, 11, 208–220.7
[5]信息技术工作组(AGIT);良好实验室规范,(GLP);在GLP环境中归档电子原始数据的指导原则,Qual. Assur. J.2003, 7,262-269
信息科技工作组(AGIT)
信息科技工作组于1998年3月27日成立,目的是探讨业界与监督部门在信息科技领域的良好实验室规范(GLP)的有关问题。
AGIT计划建立基于立法要求和实践经验的指导方针,以支持在实践中向计算机化系统引入信息技术工具支持设备测试。 经济合作与发展组织将《关于GLP原则应用于计算机化系统的共识》第10号文件作为讨论的基础。
AGIT成员有由瑞士GLP监督部门的代表(Olivier Depallens,联邦公共卫生办公室; Beat Schmid, Elisabeth Klenke, Swissmedic,瑞士医疗产品代理机构克里斯多夫摩尔,环境局联邦办公室);以及来自工业的代表(Peter Esch, Novartis Pharma AG;Stephan Hassler,哈伦实验室有限公司;Silvio Albertini, F. Hoffmann-La Roche AG;Michael Muller-Schweikart, DSM营养制品有限公司。)
为了方便用户,AGIT出版物可以在瑞士GLP主页www.glp.admin.ch,(标题:AGIT)上提供。
此外,相关指南、法律法规、定义、相关文献、培训课程、工作地点等的链接和参考资料均在瑞士GLP主页上提供。
AGIT出版物(截至2012年5月)
• 计算机化系统验证的指导原则(版本2日2007年12月)
• 在GLP中管理电子的指导原则,环境(2001年7月01日)
• 在环境中归档电子原始数据的指导原则(2003年5月01日)
• 在环境中获取和处理电子原始数据的指导原则(2005年12月01日)
• 开发和验证的指导方针,电子表格(2011年8月01日)
下一条:生产管理电子表格模板